|
8 ?% y N" y9 {6 w 铜藻别名柱囊马尾藻、海柳麦、玉海藻,属于暖温带性海藻,每年4-5月大量繁殖会造成金潮等环境问题。研究发现,铜藻中含有褐藻多酚、褐藻胶、褐藻多糖、岩藻黄质等活性成分,具有较高的营养和药用价值,可以作为化工、食品、医药等行业的优质原料。褐藻多酚是铜藻中一类重要的活性成分,不仅含量高,而且具有抗氧化、抗肿瘤、降血糖、降血脂等生物活性,在食品、保健品及化妆品等领域有较高的应用前景。
# n2 c. A9 R5 P: Z9 N( ] 研究发现植物多酚等天然产物对协助降血糖存在一定效果,并且对身体没有副作用。α-葡萄糖苷酶是调节血糖的关键性酶,可以有效调节餐后血糖,对预防和治疗糖尿病有重要意义。 8 e; F0 p& C1 u* L7 O. N! Z
为此,福建农林大学食品科学学院的何袅、李孟昱和自然资源部第三海洋研究所张怡评等人通过细胞毒性实验确定铜藻多酚的毒性,然后用铜藻多酚处理经脂多糖(LPS)诱导的巨噬细胞,检测炎症介质NO和肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和白细胞介素1β(IL-1β)的分泌量和蛋白含量变化,从而确定铜藻多酚的抗炎活性。同时以α-葡萄糖苷酶活性为指标,研究铜藻多酚对α-葡萄糖苷酶活性的抑制作用,再通过动力学分析铜藻多酚对α-葡萄糖苷酶活性的抑制类型,以期为铜藻多酚的开发利用提供理论依据。
7 w* b/ Q, U/ ~9 I- o 
' L$ `1 k: i* p, G3 | 1
8 }# j1 _- P% A- |) w( x 铜藻多酚的体外抗炎活性
2 Z4 h5 n, S; l8 f( | 1.1铜藻多酚对细胞存活率的影响(MTT实验)
( O# S& h2 v* v7 R3 K 通过判断铜藻多酚对RAW 264.7细胞的细胞毒性,确保后续实验在无毒条件下进行,以保证实验结果的准确性,细胞毒实验结果如图2所示,高质量浓度铜藻多酚对细胞活力影响较小,RAW 264.7细胞生长状况良好。由图2可知,与阴性对照对比,发现铜藻多酚质量浓度低于150 µg/mL对巨噬细胞的形态和活力没有明显的影响。
/ L# B5 u8 J3 t7 J G# k 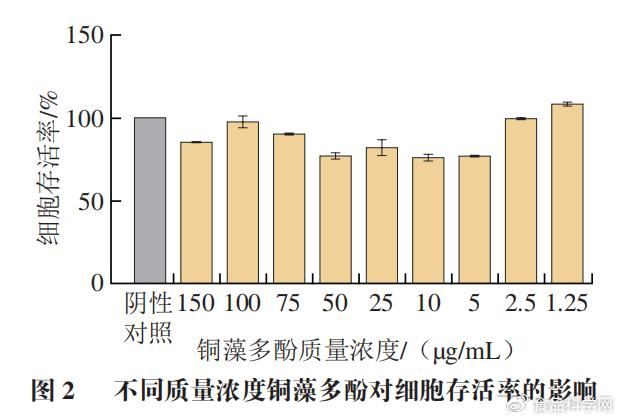 & r9 }1 Z6 X }( O$ t9 ?/ I
1.2铜藻多酚对NO分泌量的影响
% p$ i* D# Z2 V4 b 采用Griess法检测培养液中NO水平。由图3可知,与空白组(Con)相比,模型组(LPS)中NO含量显著提升(P<0.0001),说明经过LPS诱导,RAW 264.7巨噬细胞产生炎症释放大量NO,炎症细胞模型建立成功。与模型组相比,地塞米松阳性对照组(Dex(5 µmol/L))和给药组中NO含量都有明显的下降,铜藻多酚质量浓度为20 µg/mL时,NO含量变化不显著,铜藻多酚质量浓度为30、40 µg/mL两组中NO含量均表现为显著下降,从100%分别下降到76.23%(P<0.05)、62.45%(P<0.01),铜藻多酚可以有效抑制NO分泌量,说明其具有很好的抗炎活性。
# e) b4 r5 t% Q9 ~1 i4 ]1 t! [3 D 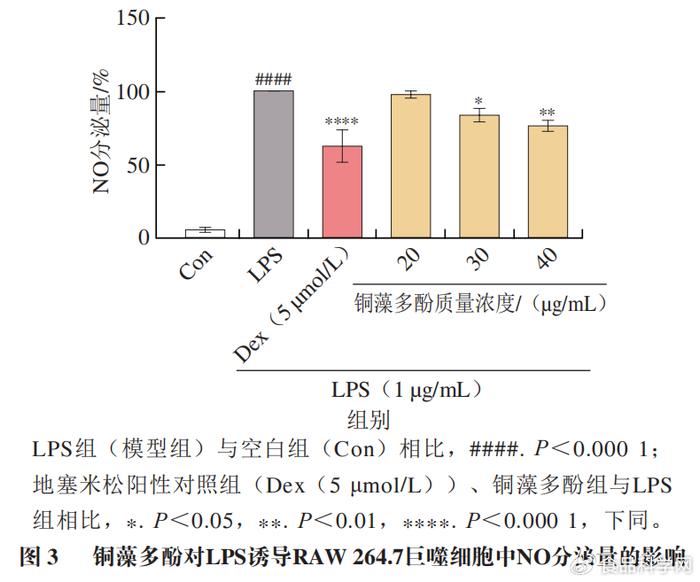
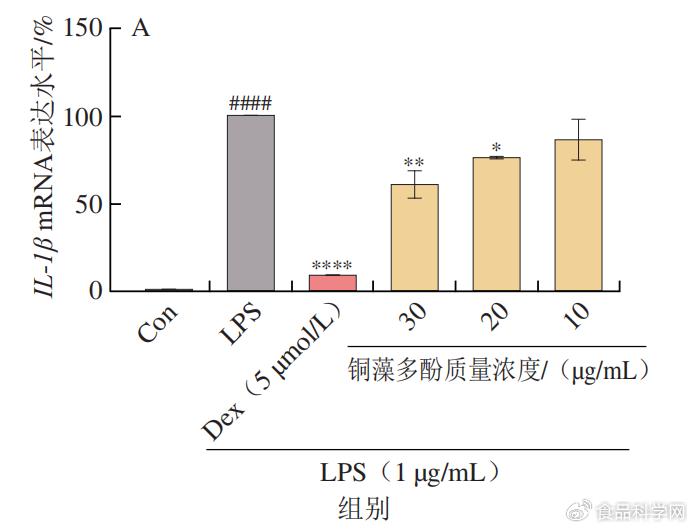
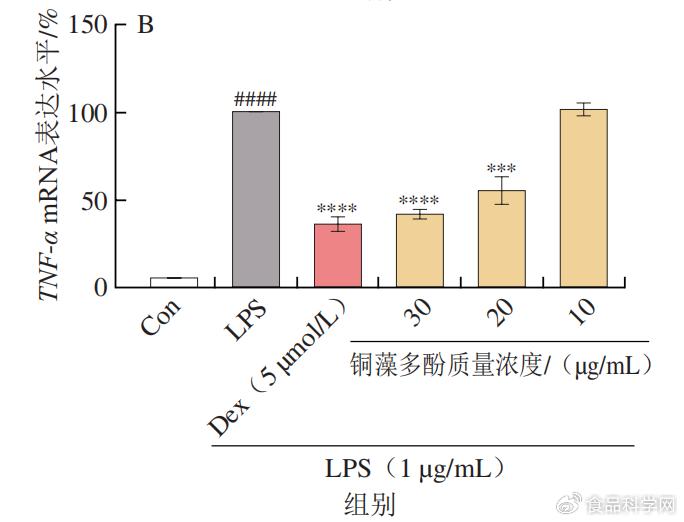
& e7 B s5 d6 a 1.3铜藻多酚对炎症因子mRNA表达水平的影响 9 a3 i# u" Z$ @- o
LPS本身为细菌细胞壁的成分,作为一种炎症介质,可以使单核巨噬细胞活化,在LPS的作用下,巨噬细胞会产生炎性因子TNF-α、IL-6和IL-1β。利用real-time PCR检测铜藻多酚能否可以改变致炎因子TNF-α、IL-6和IL-1β的表达水平。由图4可知,30 µg/mL铜藻多酚溶液显著降低LPS诱导的TNF-α、IL-6和IL-1β 3种细胞因子的mRNA下调。此外,可以发现铜藻多酚对炎性因子的抑制作用与铜藻多酚的质量浓度呈正相关。 1 } ]6 I1 q6 B3 l5 w
0 F3 o& W; v ]
' @1 _( a( p- T* [- J- c 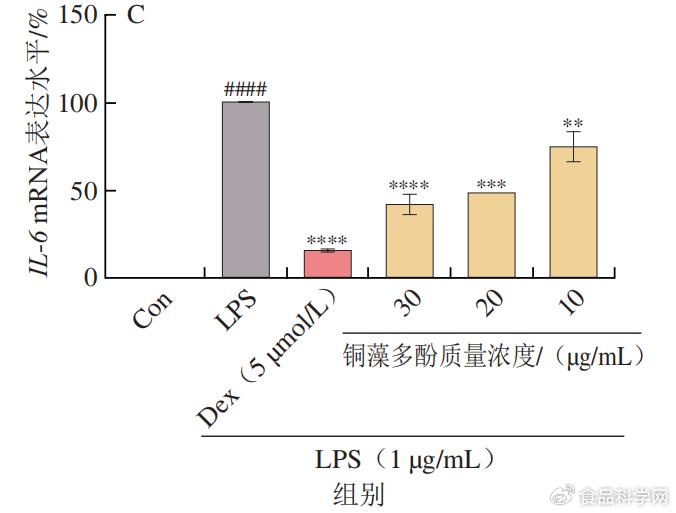
' ^1 s: |. E W; x* h 
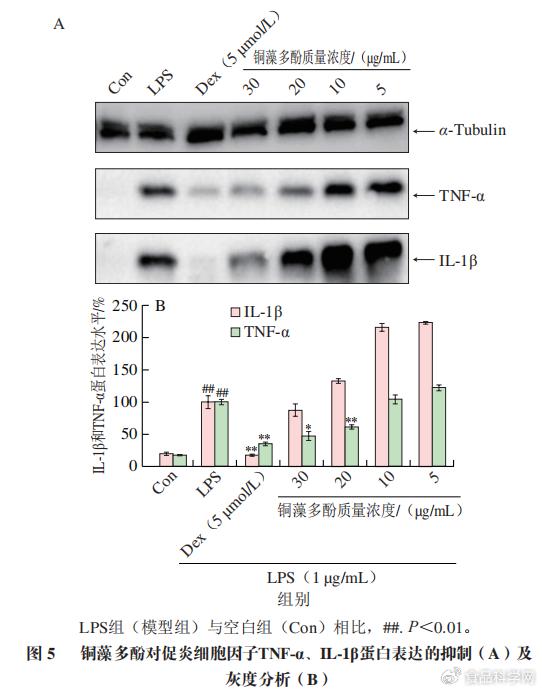
F/ s% n+ o3 }3 N y# R& u% t( S 1.4铜藻多酚对促炎细胞因子蛋白表达水平的影响 0 S0 b. m5 i# @% ^, Q$ ~& d' z1 F. @
经过LPS诱导,RAW 264.7巨噬细胞产生炎症释放IL-1β、TNF-α,细胞裂解液用免疫印迹法检测TNF-α、IL-1β和α-Tubulin。通过免疫印迹实验和灰度分析,与LPS处理组相比,发现高质量浓度铜藻多酚可以显著降低促炎细胞因子TNF-α蛋白表达,但是对IL-1β蛋白表达的抑制作用不显著(P>0.05)。由图5可知,随着铜藻多酚质量浓度增大,对促炎细胞因子TNF-α和IL-1β蛋白表达的抑制作用逐渐增强。 " \% Y. c# s+ {1 b( S+ K' Y. G" c
+ T' @" k' t6 Z. t 2
, D# w& A9 @% o+ O: O 铜藻多酚对α-葡萄糖苷酶活性的影响
# H3 ]) G9 a) m3 b' L 2.1底物浓度的选择
- `, M) C u3 R% Y% J+ ?. ~ 为了确定α-葡萄糖苷酶活性抑制实验中的最佳的PNPG浓度。本实验利用不同浓度的PNPG(0.5、1、2、3、4、5 mmol/L)和α-葡萄糖苷酶进行反应,由图6可知,随着PNPG浓度增大,α-葡萄糖苷酶对PNPG的反应能力逐渐增强。当PNPG浓度为5 mmol/L时,吸光度达到最大,此时底物和酶反应完全。所以PNPG的最适浓度为5 mmol/L。
) f+ {0 m0 A6 j( F4 @5 A; \; o. X 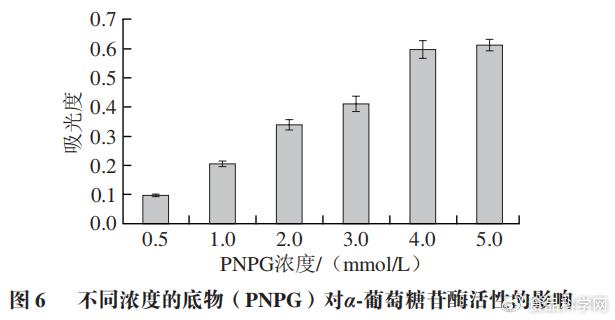 * m3 Y5 z' g% L4 h& e/ D
2.2 α-葡萄糖苷酶浓度的选择 / e# k4 F: l5 ?
当底物PNPG浓度和反应时间为定值时,在α-葡萄糖苷酶作用下,PNPG被分解成葡萄糖和PNP,随着α-葡萄糖苷酶浓度增大,分解速率不断变大。由图7可知,当α-葡萄糖苷酶活力为0.1 U/mL时,α-葡萄糖苷酶能够开始水解底物,并且酶的浓度越低,越容易与抑制剂发生反应。α-葡萄糖苷酶为0.1 U/mL时,已经能够判断铜藻多酚对α-葡萄糖苷酶活性的抑制能力。利用低浓度的α-葡萄糖苷酶能够减少酶的用量,节约成本。所以最终确定α-葡萄糖苷酶的最佳浓度为0.1 U/mL。
! I# l6 [2 r3 I1 I 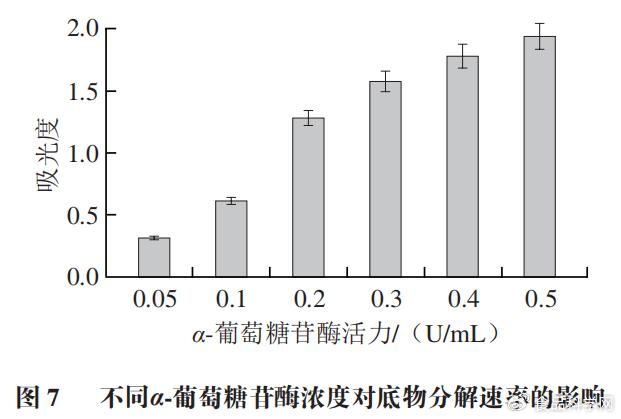 $ _5 ? f# V5 y. u2 B6 U
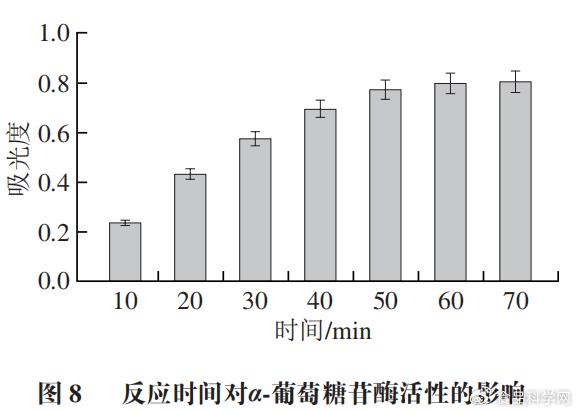
2.3反应时间的选择 ' q7 T+ \: K2 ~* u2 @
随着反应时间延长,底物和α-葡萄糖苷酶的反应越完全。由图8可知,40 min时,底物和α-葡萄糖苷酶的反应还在进行,50 min时,底物和酶的反应几乎趋于稳定,随着时间延长并未进一步反应。所以确定最佳反应时间为50 min。 % L6 Y) Q. S$ W9 L1 R
 $ b* A7 |/ T) ]% j' ]9 `2 _% }
2.4铜藻多酚对α-葡萄糖苷酶活性抑制结果
1 q2 l: J! a/ i, Y 由图9可知,铜藻多酚对α-葡萄糖苷酶活性的抑制效果为:随着铜藻多酚质量浓度增大,抑制效果逐渐增强。铜藻多酚质量浓度为25 µg/mL时抑制率达到90%以上,说明铜藻多酚对α-葡萄糖苷酶活性有较强的抑制效果。铜藻多酚对α-葡萄糖苷酶的半数抑制浓度(IC50)为5.96 µg/mL。
) t# ^; L' Q% q( Y! e6 j) A) L 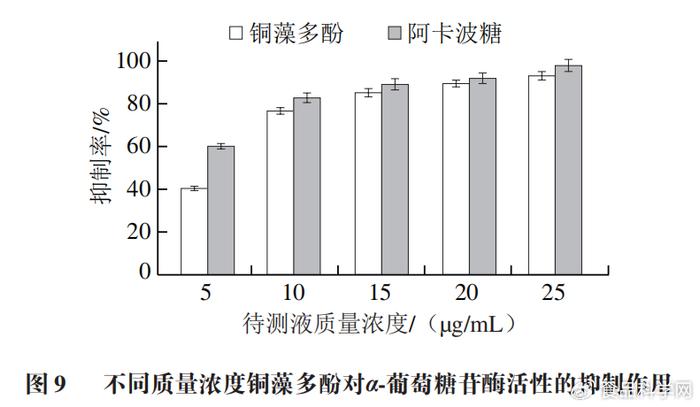
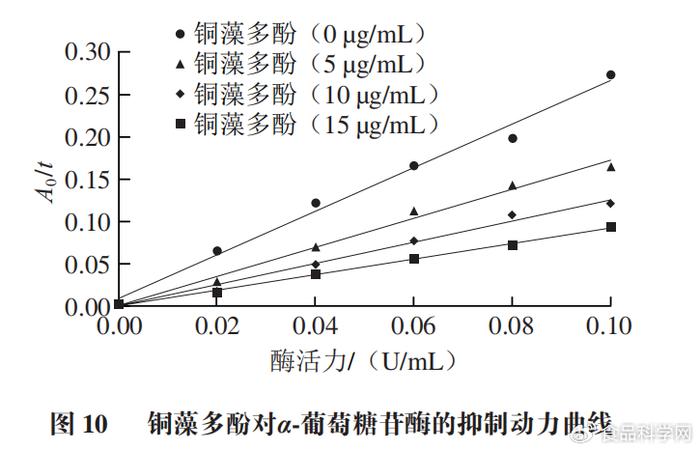
7 Y7 o* {- l& C" I 2.5α-葡萄糖苷酶抑制动力学结果 ' I/ w/ h) o$ o, O( A3 ~
抑制剂对α-葡萄糖苷酶的抑制作用包括不可逆抑制和可逆抑制两种类型。由图10可知,随着铜藻多酚质量浓度增大,直线斜率逐渐减小,同时所有直线都基本过原点,说明铜藻多酚对α-葡萄糖苷酶的抑制作用是可逆的。 & ?. h7 k$ n8 \. a
6 c, Z3 U( x$ a 为了确定铜藻多酚对α-葡萄糖苷酶的可逆抑制类型,按照Lineweaver-Burk双倒数曲线作图法,研究铜藻多酚质量浓度、底物浓度和酶解速率之间的关系,确定抑制类型和抑制常数。由Lineweaver-Burk双倒数曲线图11可知,随着铜藻多酚质量浓度降低,α-葡萄糖苷酶的酶解速率明显升高。随着底物浓度增加,酶解速率也不断增大。说明铜藻多酚优先与酶结合,从而使葡萄糖苷酶活性下降。
6 s& o+ j1 W- _) [ 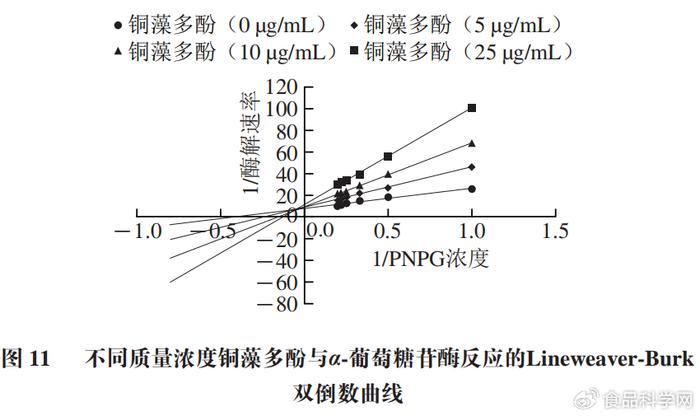 8 m& s7 b! F' J5 [; f( k
通过Lineweaver-Burk双倒数曲线可以看出米氏常数Km和最大酶解速率Vmax值的变化,Km和Vmax的比值为斜率,Y轴截距为1/Vmax,Km和Vmax的比值随着铜藻多酚质量浓度增大而增大。通过Dixon图(图12)可以看出,不同质量浓度铜藻多酚直线相交于第2象限,交点接近Y轴,说明铜藻多酚对α-葡萄糖苷酶的抑制作用是混合抑制。Lineweaver-Burk双倒数曲线中交点的横坐标的绝对值表示竞争性抑制常数Kic值,而Dixon图中交点横坐标的绝对值表示非竞争性抑制常数Kiu值。计算得到铜藻多酚对α-葡萄糖苷酶的Kic值为0.06 µg/mL,Kiu值为6.68 µg/mL。非竞争性常数大于竞争性常数,说明铜藻多酚对α-葡萄糖苷酶的抑制类型是非竞争性大于竞争性的混合可逆性抑制类型,具体数值如表2所示。 # j1 E ?' J; G5 I" ]; g
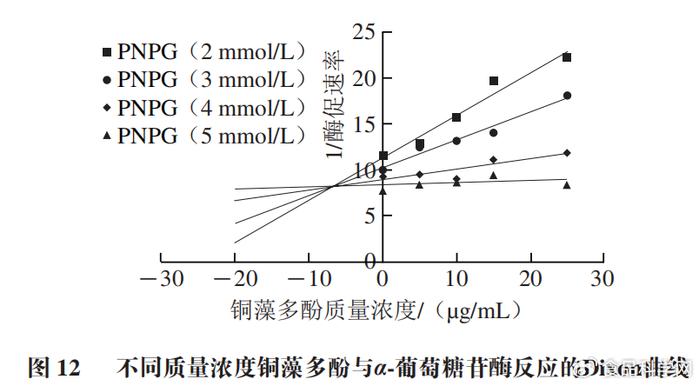
# a( X' L" ~& a# m 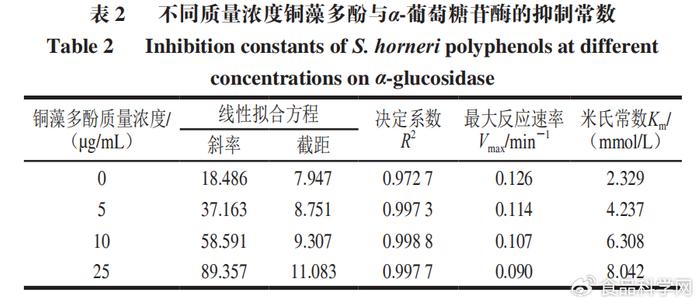
/ W) E j" Z# Y c9 V 3
/ C0 }1 K! A( L4 m) r 讨论
4 l! K; W2 t0 y& q 糖尿病并发症发生的主要因素是炎症,研究发现植物多酚不仅对糖尿病并发症有一定的抑制作用,而且能够直接降血糖。本实验研究了铜藻多酚的体外抗炎活性,利用LPS诱导RAW 264.7巨噬细胞建立体外炎症模型。结果表明,通过细胞毒实验(MTT法)检测铜藻多酚质量浓度在1.25~150 µg/mL之间时,细胞存活率高,说明铜藻多酚没有明显的细胞毒性。40 µg/mL铜藻多酚显著降低炎症介质中NO含量,30 µg/mL的铜藻多酚可以使IL-1β、TNF-α和IL-63种细胞因子的mRNA水平显著下调,对炎症因子TNF-α的蛋白表达水平有显著抑制作用,但是对炎症因子IL-1β蛋白表达水平抑制作用不显著,具有较强的抗炎活性,与纯化后咖啡果壳多酚的抗炎活性相比,铜藻多酚的对炎症因子的蛋白和mRNA水平的抑制作用更明显。铜藻多酚对α-葡萄糖苷酶的活性有明显抑制效果,并且随着铜藻多酚质量浓度增大抑制效果逐渐增强,铜藻多酚对α-葡萄糖苷酶的IC50为5.96 µg/mL,说明铜藻多酚对α-葡萄糖苷酶活性有较强的抑制效果,明显高于红景天多酚对α-葡萄糖苷酶的IC50(2.83 mg/mL)。根据双倒数曲线可知,铜藻多酚对α-葡萄糖苷酶的Kic值为0.06 µg/mL,Kiu值为6.68 µg/mL,非竞争性常数Kiu值大于竞争性常数Kic值,说明铜藻多酚对α-葡萄糖苷酶的抑制类型是非竞争性大于竞争性的混合可逆性抑制类型。综上,铜藻多酚具有抗炎活性和降血糖活性,可以作为化工、食品、医药等行业的优质原料。
/ X2 e# p4 c0 w8 g4 |+ C% b9 P. [ 本文《铜藻多酚的体外抗炎和降血糖活性》来源于《食品科学》2024年45卷3期68-75页,作者:何袅袅,李孟昱,蔡树芸,施丽君,陈伟珠,陈晖,洪专,张怡,张怡评。DOI:10.7506/spkx1002-6630-20230417-175。
5 D8 y. s" c" Y& G# a/ l S* }# U3 C0 D  * ^$ M* X" M' ^' _# I# T

' y' `1 r% a, r4 ]0 G/ @0 m1 e7 |0 W
- ?) X) o% H* N) _0 Y1 j% t
3 y! e# q/ u# H* w; i! z( v
) d9 r. w" }& W$ h1 R K# a, g. v! @) _. e3 F
6 n% I) Z! q/ V- W( n& l$ ]4 X. w8 r7 O
7 g6 o9 P! y; w& K* c' N; `- ~* R$ A C! X4 B$ A
- q1 F7 t2 a0 \$ }" A- A9 _
7 G$ x1 m/ p/ X3 D4 k7 v* I | 

